Isobar prosess
Mal:Kildeløs En isobar prosess er en termodynamisk prosess der trykket er konstant, . Varmen som blir overført til systemet gjør et arbeid, men endrer også den indre energien til systemet:
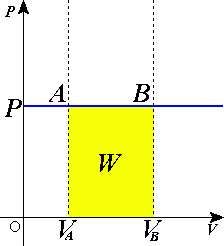
ifølge termodynamikkens første lov der W er arbeidet gjort av systemet, U er indre energi, og Q er varme. Trykk-volumarbeid (av systemet) er definert som:
men siden trykket er konstant betyr dette at
- .
Ved å bruke den ideelle gassloven får vi
hvis vi tenker oss at mengden av gass er konstant (for eksempel ingen faseendringer). Siden det generelt er slik at
så kan en sette de to siste ligningene inn i den første ligningen:
- .
Størrelsen i parentes er den spesifikke varmen ved konstant trykk:
og dersom gassen ligningen gjelder for er enatomisk er og .
Entalpi
En isokor prosess er skildret som . En kan få en lignende ligning for isobare prosesser. Om en setter inn den andre ligningen i den første får vi
Størrelsen U + P V er en tilstandsfunksjon kalt entalpi, og blir uttrykt som H. Derfor kan en beskrive en isobar prosess som
- .